神经病理性疼痛(neuropathic pain)是由躯体感觉神经系统损伤或疾病引起的疼痛,包括三叉神经痛、偏头痛、坐骨神经痛等,给患者带来极大的身体伤害与精神负担。但目前临床常用的镇痛药物治疗效果有限,副作用明显,且易产生成瘾及耐受性。因此,揭示内源性驱动神经病理痛的细胞和分子机制,对于开发新的预防和治疗策略具有重要意义。下丘脑弓状核(arcuate nucleus,ARC)是哺乳动物第三脑室周围进化保守的区域,也是内源性阿片肽系统的关键组成部分。研究表明,密集分布于ARC的β-内啡肽能神经元合成并释放β-内啡肽,并在疼痛的内源性调节中起重要作用。本文阐明了外周神经损伤后,ARC中调控β-EP合成的上游调控因子及表观遗传机制,旨在为发现镇痛药物新靶点提供一定的科学依据。
近日,bwin必赢陶金教授团队在Nature Communications期刊发表题为Epigenetic regulation of beta-endorphin synthesis in hypothalamic arcuate nucleus neurons modulates neuropathic pain in a rodent pain model的研究论文。该研究揭示了神经损伤后,ARC中组蛋白乙酰化介导的miR-203a-3p上调抑制了β-EP的合成途径,进而参与神经病理性疼痛的表观调控机制。

该研究团队通过建立大鼠眶下神经慢性压迫性损伤模型(CCI-ION),应用全转录组高通量测序技术,分析并筛选出上调最为显著的miR-203a-3p,并在三叉神经痛患者脑脊液中得到验证。随后,作者通过遗传学方法调控ARC神经元中miR-203a-3p表达,并研究大鼠疼痛相关机械痛阈值的变化,证实了ARC中miR-203a-3p是一个参与三叉神经病理痛调节的关键功能性非编码RNA。随后,作者研究了调控miR-203a-3p转录的上游机制,通过构建其启动子的截短体质粒筛选出核心启动子,并通过突变转录因子结合位点筛选出关键转录因子NR4A2。进一步的研究发现外周神经损伤引起组蛋白去乙酰化酶HDAC9表达下调,提高了miR-203a-3p基因启动子上H3K18ac的富集程度,从而有利于转录因子NR4A2结合并促进miR-203a-3p基因的转录。慢病毒过表达HDAC9可以逆转CCI-ION模型大鼠ARC中miR-203a-3p的高表达,而在野生型大鼠ARC中通过siRNA敲低HDAC9可以导致miR-203a-3p的表达上调。通过研究miR-203a-3p的下游靶点,作者发现其可以靶向抑制蛋白转化酶PC1的表达。PC1是将黑皮素原POMC剪切为β-EP所必需的一个酶,外周神经损伤后的PC1表达降低可能会导致ARC中的β-EP合成能力下降,从而诱发大鼠机械痛敏,而恢复PC1的表达可以缓解大鼠的机械痛敏行为。上述研究阐明了一条新的疼痛表观调控通路:外周神经损伤后,组蛋白去乙酰化酶HDAC9表达下调,诱导miR-203a-3p基因启动子区H3K18ac富集,从而有利于转录因子NR4A2结合并促进miR-203a-3p表达。miR-203a-3p的上调靶向抑制其靶点前蛋白转化酶PC1的表达,导致β-EP合成途径受阻,β-EP水平持续大幅下降,最终引起痛敏。
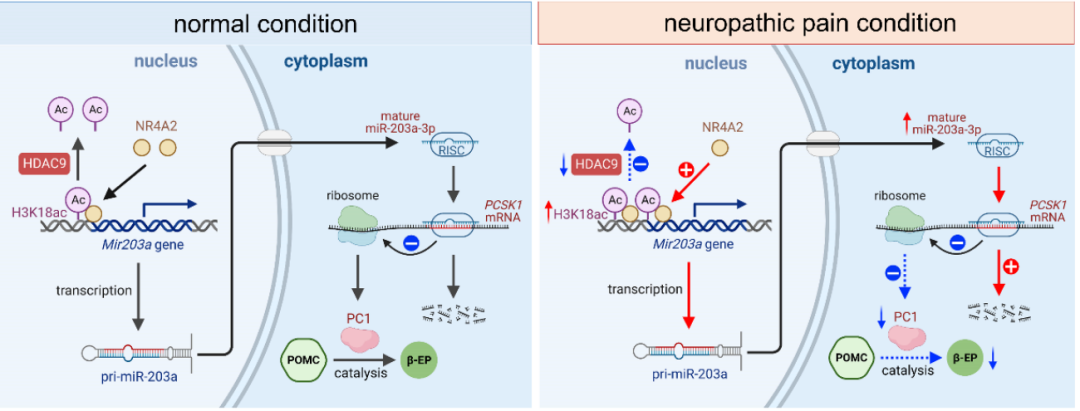
综上,该项工作揭示了中枢核团ARC神经元miR-203a-3p是三叉神经病理痛中一种关键的功能性非编码RNA,可以通过调控ARC中内源性β-EP的合成而影响痛行为。结合该实验室前期在外周感觉神经元中疼痛表观调控的研究成果(Qi et al., Proc Natl Acad Sci, 2022;Wang et al., Science Signaling, 2019),及miRNA介导的基因调控在疾病治疗中的重要性,提示某些特定的非编码miRNA(如miR-203a-3p)及相关通路的表观调控因子可能是三叉神经病理痛药物开发和治疗的潜在靶点。
文章链接:https://www.nature.com/articles/s41467-023-43022-7